五味子是一类非常有价值的药用植物,其中一个重要成分是木脂素,它具有鲜明的结构特征:即含有一个高度氧化的联苯环辛二烯骨架(DBCOD)。然而,目前针对DBCOD型木脂素的生物合成研究相对有限,一条假设的生源合成路径如下所示(图1a):木质素经过氧化偶联和还原后,生成pregomisin (1);后者经对映选择性氧化环化后形成这个家族分子中特色的DBCOD结构。归为阶段1型DBCOD分子的特征是:脂肪链上的C6和C9饱和,C7和C8的构型分别是S和R,并且拥有联芳基轴手性。该阶段分子再度氧化后,在C7位引入三级醇,并在C6和C9位安装OAc、OBz或OAng基团,便得到了阶段2型DBCOD分子,如Schizanrin F (2)。接着,将C19位的甲基进行C-H键氧化后,生成的自由基既可以发生5-exo环化,也可以进行11-endo自由基环化,从而促使了氧化程度最高、结构最为复杂的阶段3型DBCOD分子的生成。Kadsuphilin N (5)、Kadsulignan E (7)、Heteroclitin J (8)以及Taiwankadsurin A/B (9a & 9b)都属于该阶段的分子。事实上,在生物体内细胞色素P450或非血红素氧化酶参与的氧化反应通常以两种途径(“经典”氧化和“非经典”氧化)进行,两者的区别在于底物中的自由基是否先异构化,再与Fe(III)-OH结合。若不经异构化,则称为“经典”氧化;反之,则是“非经典”氧化(图1b)。而DBCOD型木脂素从阶段2到阶段3,就需要利用“非经典”氧化反应。
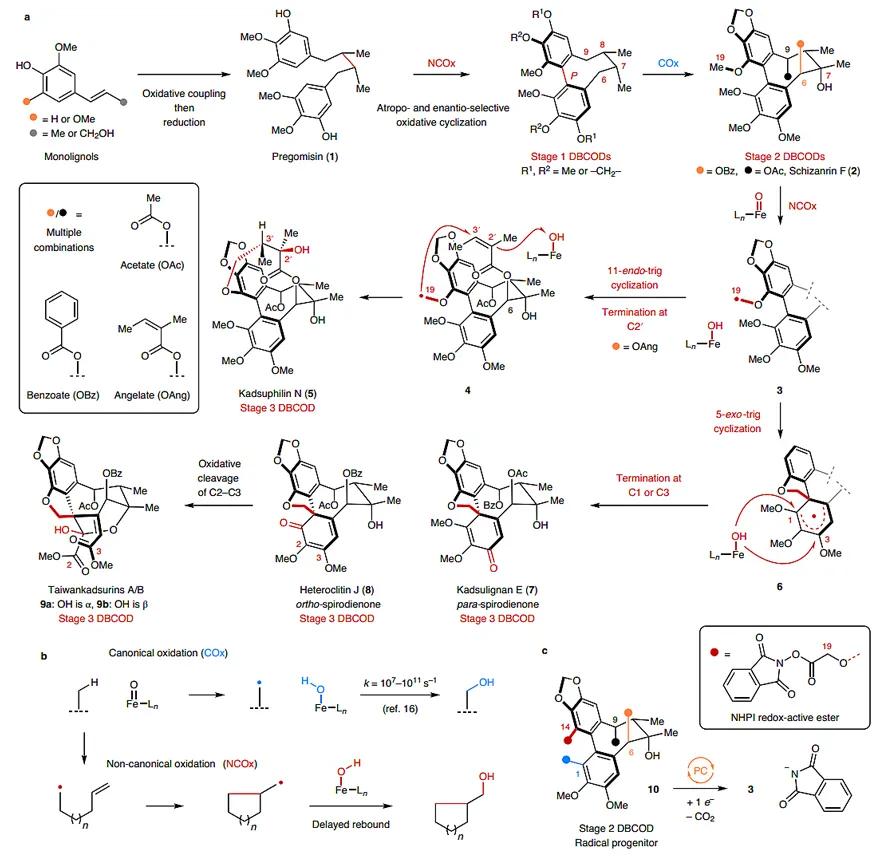
图1. DBCOD型木脂素的假设生源合成路径和光催化氧化还原反应模拟非典型氧化环化过程。图片来源:Nat. Chem.
2013年,T. V. RajanBabu首次报道了Schizanrin F (2)的全合成(Chem. Sci., 2013,4, 3979–3985),但是该过程需要26步线性反应,并且只得到6.5 mg产物。在此基础上,加拿大麦吉尔大学的Jean-Philip Lumb教授团队尝试发展一条更简洁的替代方法,即通过在底物中C19位引入NHPI基团,利用光催化氧化还原反应,模拟了生物体内酶催化的“非经典”氧化环化过程,首次实现了阶段3型DBCOD型木脂素分子的全合成(图1c)。相关成果发表在Nature Chemistry 上。
首先,来介绍一下逆合成路线:化合物10可以从化合物11a和11b出发,并且在联芳基偶联前,预先在化合物11a/11b的C6、C7、C9位引入氧化态。然而,化合物10中C6和C9位的酯基处于假直立式,碍于位阻效应,芳基-芳基偶联会受到排斥。事实上,由于烯丙基张力作用,与最终化合物10匹配的构象异构体11a占少数,而不期望的构象11b占主导。所以,作者对逆合成路线做了两项调整。第一,翻转C6位的构型(化合物12vs. 10);第二,将C9位的羟基和C15位的转金属化基团连在一起(化合物13),该设计既能消除烯丙基张力,又利于立体专一性偶联。其中化合物13可以通过酮14和醛15发生aldol反应得到,而酮14和醛15又可以由化合物16和17制备而来。
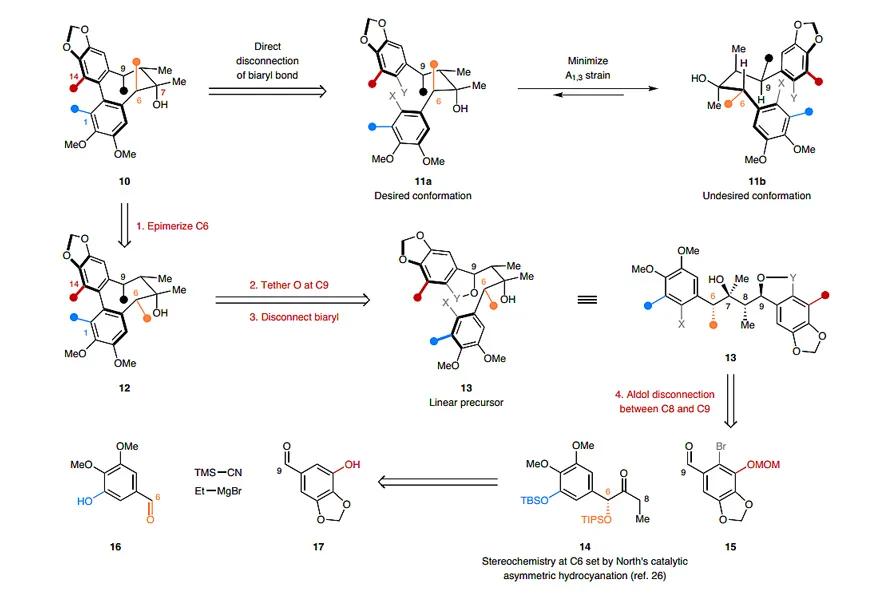
图2. 阶段2型DBCOD木脂素分子的逆合成分析。图片来源:Nat. Chem.
于是,作者开始了阶段2型DBCOD木脂素分子的合成(图3)。参考Heathcock的反应条件,酮14在TMPMgBr作用下,得到E-式烯醇,随后加入Cy2BCl(B原子替代Mg与O络合),再向体系中加入醛15,反应经由过渡态TS-I,以79%的收率和20:1的d.r.值得到13g产物18,后者经Bartoli条件在C7位安装叔醇,以70%的收率和3:1的d.r.值得到14 g化合物19。若以3 g规模进行反应,那么能得到7:1的d.r.值,这可能是因为在非均相体系中搅拌不均匀导致的。接着,甲基硼酸先和C7位、C9位的羟基络合生成六元环的甲基硼酸酯,并用叔丁基锂进行锂-卤交换,使得中间体20发生分子内硼到碳的迁移,从而得到苯基硼酸酯21。接着脱除C1位的TBS保护基,并利用酚羟基导向的溴化反应在C16位安装溴原子,得到Suziki偶联反应的前体22。
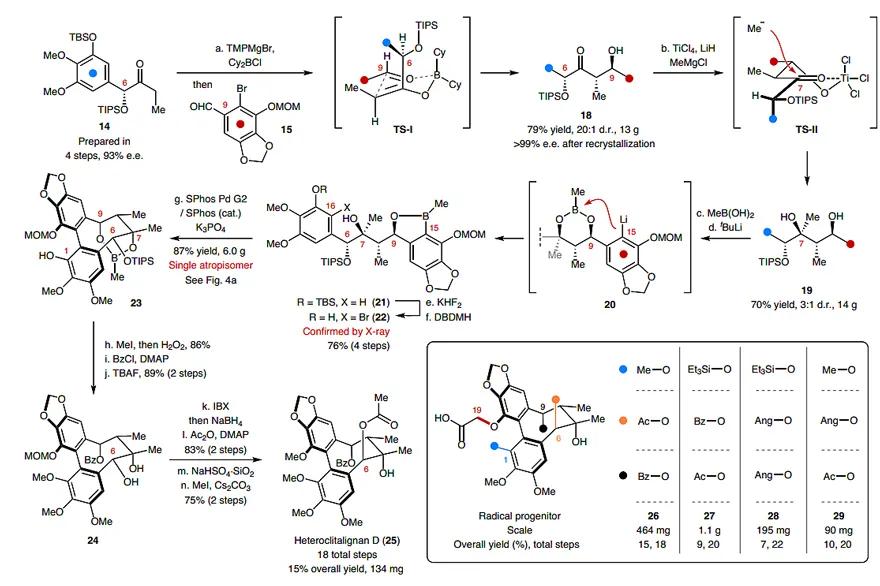
图3. 阶段2型DBCOD木脂素分子的合成。图片来源:Nat. Chem.
经过大量的条件摸索(图4a),作者发现使用20 mol % Buchwald发展的Sphos-Pd-G2催化剂、20 mol % SPhos、5当量K3PO4在甲苯中于60 ℃下反应,能以87%的分离收率得到6 g单一的非对映异构体6。随后,作者对该偶联反应进行了深入的解析。因为中间体32(钯杂九元环)是刚性的结构,作者推测它不会发生明显的阻转异构化,所以决定立体构型的过程就是转金属化过程。起初作者认为C7位的羟基活化了硼酸酯(图5,Pathway 1),但是却得到了几何上不利于这种相互作用的7-epi-22,这说明其他因素在起作用。值得一提的是,在条件优化过程中,作者发现少量的水是反应成功的关键,然而2当量的水又会抑制反应。一开始作者怀疑水可能导致环状硼酸酯水解成非环状硼酸酯(图5,Pathway 2),但是D6-22的交叉实验推翻了这一假设,这是因为在反应过程中B一直在同一分子中,不会发生交换。最后,作者参考了Denmark和Hartwig的工作,认为Suzuki偶联反应中的转金属化发生在芳基-Pd(II)-OH物种和中性硼酸酯之间(图5,Pathway 3)。
于是,作者提出了如下催化路径(图4c)。底物22经氧化加成得到中间体30;催化量的水在碱的作用下与Br负离子发生配体交换,形成中间体31。而过量的水会导致硼酸酯的水解,所以反应效果差。中间体经四元环过渡态进行转金属化,并在此过程中将底物22中C6和C9位的点手性传递到产物23的轴手性。作者利用11步反应,实现了化合物23的克级制备,后者经过几步官能团调整:C1位羟基上甲基,利用H2O2脱除硼酸酯,随后对C9位羟基进行Bz保护,再脱除C6位TIPS保护基,利用RanjanBabu发展的氧化还原连续反应,对C6位的手性构型进行翻转。最后,对C6位羟基上Ac保护基,并脱除MOM保护基再对该酚羟基上甲基。至此,作者以18步反应、15%的总收率得到了>100 mg的 Heteroclitalignan(25)。从化合物23出发,作者还分别实现了其他非天然类似物(26-29)的合成,且最大规模可达到克级。
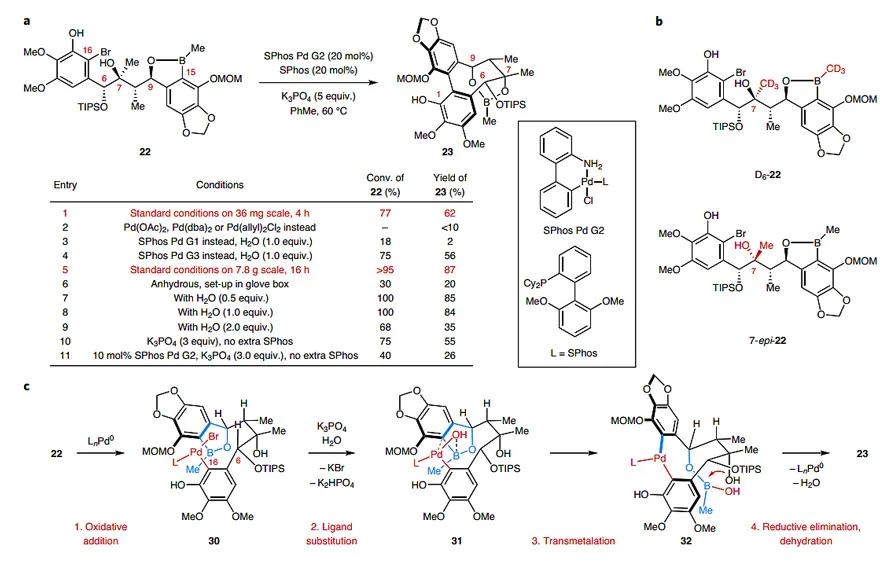
图4. Suzuki偶联反应的研究。图片来源:Nat. Chem.
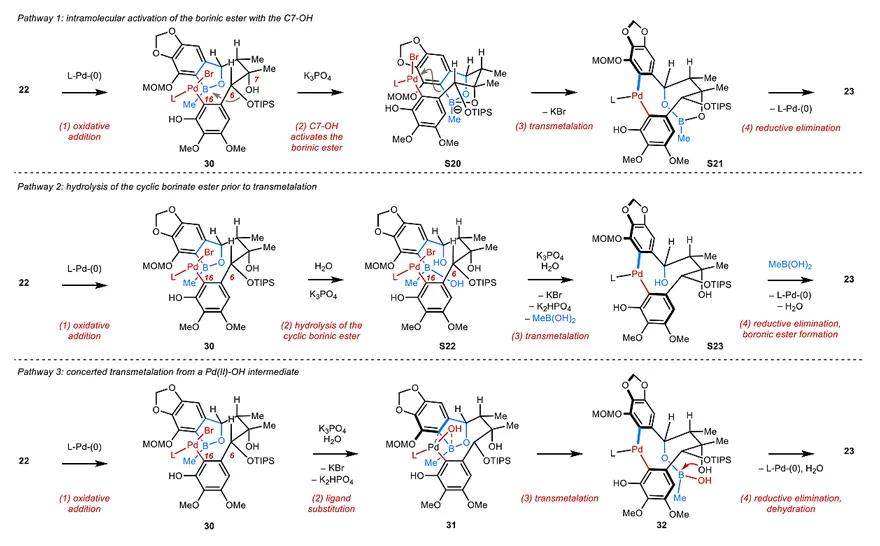
图5. Suzuki偶联反应中水的作用。图片来源:Nat. Chem.
接下来便是本文的重中之重了—如何利用自由基化学实现阶段3型DBCOD分子的合成。为此,作者从Kadsulignan E (7) 和heteroclitin J (8)着手(图6)。作者推测底物33中的NHPI基团在氢键作用下会经历单电子还原得到中间体34,随后经5-exo-trig环化促使中间体35的生成。后者发生单电子氧化,得到戊二烯正离子36,其C3位接受水的加成后,再伴随一分子甲醇的离去,便会得到化合物Kadsulignan E(7)。幸运的是,采用Glorius团队的反应条件:2 mol % [Ir(ppy)2(dtbpy)(PF6)]、100当量水,在蓝光照射下,化合物33能顺利发生反应,最后以43%的分离收率得到单一的异构体7,它含有对位螺环二烯酮结构,相反,化合物8中的螺环二烯酮处于邻位。针对这一差别,作者的应对策略是在化合物37的C1位引入硅醚基团,当C19位自由基发生5-exo-trig环化得到中间体38,再经历单电子氧化生成中间体39后,C1位上羟基连的TES会离去,随之生成heteroclitin J (8)。这里作者采用的是Overman团队的合成条件:1 mol %Ru(bpy)3(PF6)2和2当量Et3N,由于Et3N可以直接将激发态的Ru(II)物种还原成Ru(I),这份还原电势足够对NHPI基团进行单电子还原,不需额外的氢键作用,所以反应体系应保持无水。最后以88%的收率制备了250 mg heteroclitin J (8)。另外,Taiwankadsurin A和B是从菲律宾南五味子中分离得到的天然产物,目前有关其生源合成暂不清楚。为此,作者从化合物8出发,利用臭氧断裂C2和C3间的碳碳双键,得到的中间体40自发关环形成半缩酮9a和9b,最后以70%的总收率、9:1的d.r.值得到Taiwankadsurin A和B。
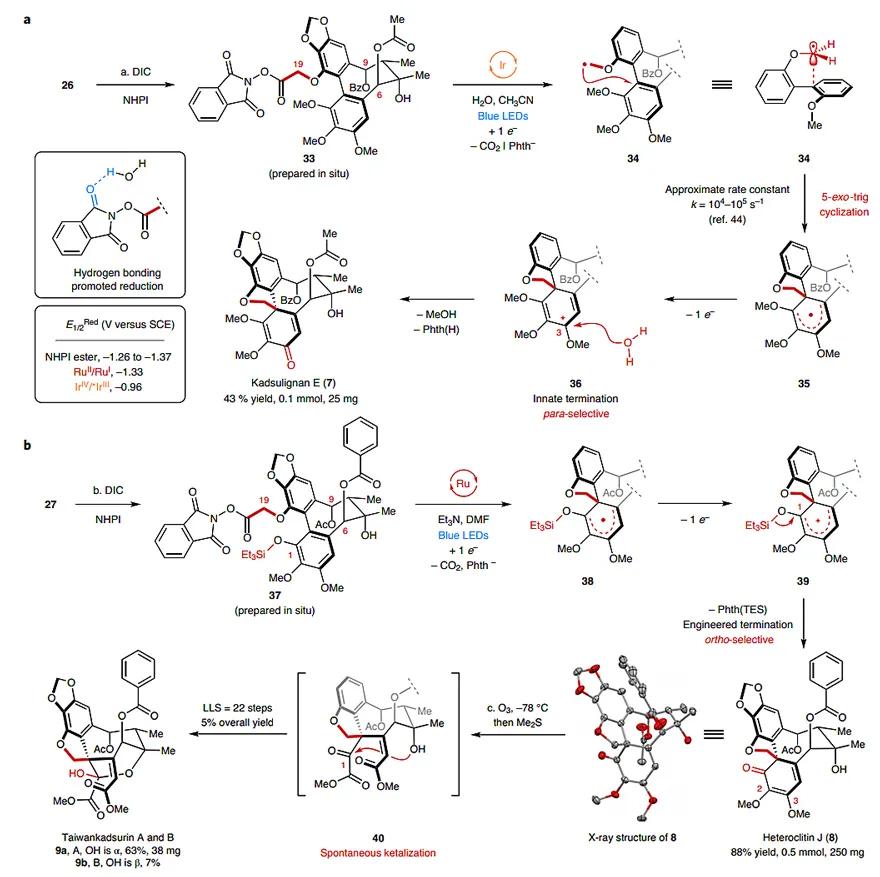
图6. 光氧化还原反应研究之一。图片来源:Nat. Chem.
最后,作者尝试合成DBCOD家族中含有桥环骨架的大环内酯分子kadsuphilin N(5)(图7)。然而,目前还没有相关的化学或生物合成报道。值得一提的是,无论化合物41还是42在Ru催化剂/光照的条件下生成的中间体43都不会发生5-exo-trig环化反应,相反它们会从Si面进行11-endo-trig环化反应得到中间体45,后者很快会被淬灭,生成相应的中间体46/47和48/49。虽然将Et3N换成DIPEA能提高总产率,但没有改善产物的比例。向体系中添加Hantzsch酯会提高化合物49的收率,但是kadsuphilin N(5)的合成需要在化合物49的C2’位进行羟基化,该过程难度较大。为此,作者打算仿照生物合成,直接对中间体45进行自由基终止得到kadsuphilin N(5),但是向体系中加入TEMPO(50)或二苯基二硒化物(51)后,仅得到化合物52/53。最终作者采取Fu团队发展的钯介导的光催化反应条件,由于Pd易发生β-H消除,所以化合物47是主产物,收率53%。接着,参照Mukaiyama的水合反应条件,化合物47能以78%的收率和5:1的d.r.值得到kadsuphilin N (5)。从化合物41和52的淬灭实验可看出,11-endo-trig的反应速率不高于105 s-1,这个速率比5-exo-trig慢,所以作者认为不能排除如下可能性:即5-exo-trig环化成螺环是可逆的。Heteroclitin J (8)在DBU和甲醇的条件下脱除了C6位的Bz保护基和C9位的Ac保护基,随后C9位的醇进行分子内共轭加成,得到桥环四氢呋喃54,后者在强碱和Ang2O的作用下,以87%的分离收率得到Kadsuphilol G (55)。同时,逆氧杂Michael加成反应也会发生,游离出来的C9位羟基被Ang保护,便得到了kadsulignan D (44),收率11%。
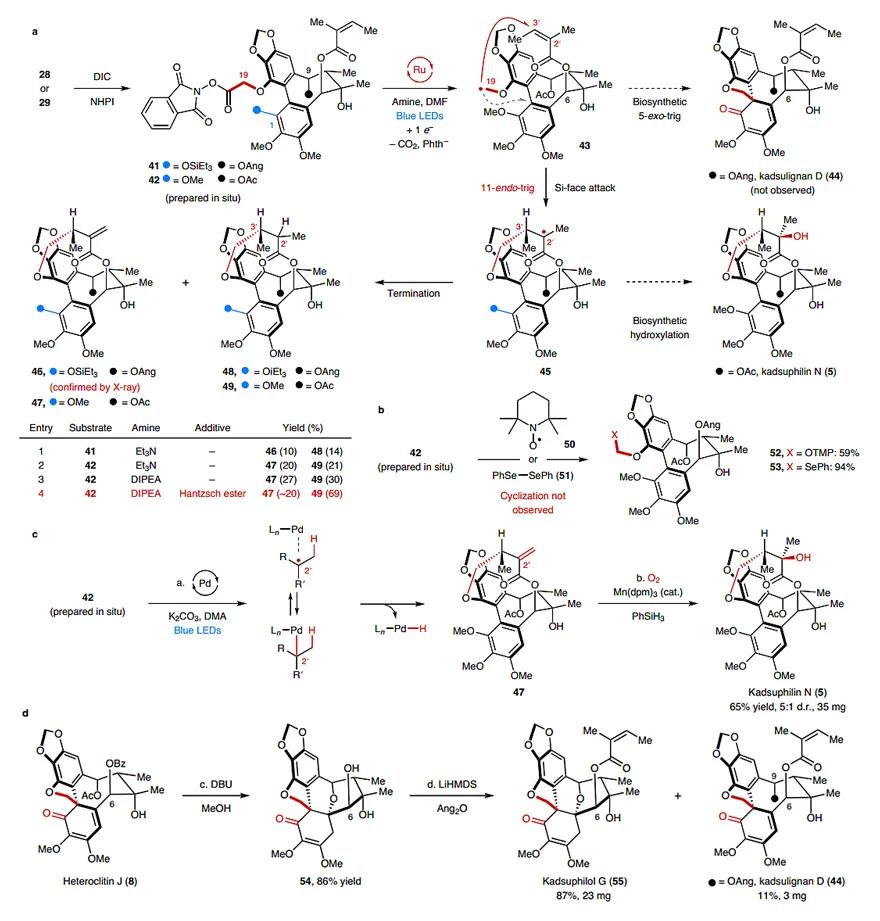
图7. 光氧化还原反应研究之二。图片来源:Nat. Chem.
总结
Jean-Philip Lumb教授团队利用最近发展迅猛的光催化氧化还原反应,完成了亲核性自由基对富电性芳环/烯烃的加成,构建了复杂的螺环/桥环等多环骨架,实现了DBCOD型木脂素家族多个分子的全合成。这不仅有利于后续对这类家族分子生物合成的探索,还有助于药学家研究它们的药理学性质。


