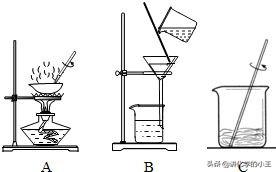
①蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出,叫蒸发结晶。例如:当NaCl和KNO3的混合物中NaCl多而KNO3少时,即可采用此法,先分离出NaCl,再分离出KNO3。
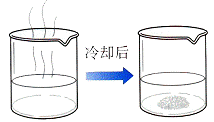
②降温结晶:先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出,叫降温结晶。例如:当NaCl和KNO3的混合物中KNO3多而NaCl少时,即可采用此法,先分离出KNO3,再分离出NaCl。
【注】蒸发结晶指的是溶液通过溶剂的散失(即蒸发),使得溶液达到饱和状态,继而达到过饱和状态。由于在一定的温度下,一定量的水(或溶剂)所能溶解的某一溶质的质量是有限的,那么多余的溶质就会随着溶剂的减少而析出,即结晶。它适用于温度对溶解度影响不大的物质。沿海地区“晒盐”就是利用的这种方法。
蒸发结晶适用于一切固体溶质从他们的溶液中分离,或从含两种以上溶质的混合溶液中提纯随温度的变化溶解度变化不大的物质,如从氯化钠与硝酸钾混合溶液中提纯氯化钠(硝酸钾少量),此时蒸发结晶不能将溶剂全部蒸干。而我们高中氯化钠提纯实验中因为只有一种溶质(氯化钠),所以采用的蒸发结晶是将溶剂水全部蒸干。
【注】冷却结晶是指饱和溶液通过降低溶液的温度,使溶质析出的方法。一般来说,溶液的温度越高,一定质量的溶剂所能溶解的某一溶质的质量越大,那么降低溶液的温度,就会有溶质析出。此法适用于温度升高,溶解度也增加的物质。如北方地区的盐湖,夏天温度高,湖面上无晶体出现;每到冬季,气温降低,纯碱(Na2CO3·10H2O)、芒硝(Na2SO4·10H2O)等物质就从盐湖里析出来。在实验室里为获得较大的完整晶体,常使用缓慢降低温度,减慢结晶速率的方法。
冷却结晶主要对于混合溶液含有两种以上溶质,且有一种随温度的变化溶解度变化较大,提纯它就用冷却结晶,如从氯化钠与硝酸钾混合溶液中提纯硝酸钾(氯化钠少量)。
【注】升温结晶
如果这个物质的溶解度随温度的升高而减小,这种物质我们可以采用升温结晶,不过这种物质很少,所以也很少用。



